Как в Петербурге спасают безнадежных больных с помощью пилюль с кишечными бактериями?
17:08 27/07/2022«Доктор Стрэндж» в зеленом халате
На Петроградской стороне – на улице Рентгена, на базе корпуса Первого меда, как в Петербурге по-свойски называют Медицинский университет имени Павлова, есть отдельный въезд и парадный вход с неприметной с улицы надписью «Институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой».
Сюда даже после отмены строгих ограничений не пускают без масок и действующих ПЦР-тестов. На крыльце в ярко-зеленом медицинском халате почти в пол, словно Доктор Стрэндж, супергерой популярной киновселенной, нас встречает тоже доктор – заведующий отделением реанимации и интенсивной терапии Олег Голощапов. Тоже, как потом выяснится, в каком-то смысле супергерой, правда, совсем не вымышленный.
«Меня без зеленого халата уже не узнают. Это мои старые венские халаты – там просто все реаниматологи носили вот эти зеленые халаты. Мне это ужасно понравилось! Это очень выделяло среди других врачей. С тех пор я снимаю только в отпуске, наверное, его», – говорит заведующий отделением реанимации и интенсивной терапии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой Олег Голощапов.
СПРАВКА: Олег Голощапов с отличием окончил Петербургскую Педиатрическую Медицинскую Академию в 1995 году. За три года работы врачом анестезиологом-реаниматологом дорос до заведующего отделением. Несколько лет стажировался и работал – в Германии и Австрии. Имеет научные публикации в ведущих российских и зарубежных изданиях. Научные интересы: вирусология, иммунология, сепсис, микробиология и трансплантация фекальной микробиоты.
Пока мы идем за врачом, у него постоянно звонит телефон. Это и отчаявшиеся пациенты, которым больше ничего не помогает, и коллеги из других регионов. Они интересуются опытом института в области лечения последствий онкозаболеваний и иммунодефицитов. По пути из одного лифта в другой нашего «Доктора Стрэнджа» постоянно поздравляют проходящие мимо медики. Этим летом за спасение умиравшего после трансплантации костного мозга пациента он с коллегами получил главную медицинскую премию года – «Призвание». Авторами нового метода стали именно реаниматологи, которые пошли на отчаянный шаг – пересадить человеку кишечные микробы донора, помещенные в обычные белые капсулы.
«Как материал используются именно фекалии человека. Но в дальнейшем они поступают в лабораторию, фильтруются, из них удаляется вся клетчатка, остатки пищи, они проходят многочисленные фильтры, чтобы остались действительно только бактерии. Здесь основной момент – это специальные вещества, которые называются «криопротекторами» для того, чтобы при минус 80-ти эти микробы остались живы при разморозке», – объясняет Олег Голощапов.
Фекалии против рака
Из морозилки Олег Валерьевич достает два пакетика. В каждом по 15 белых пилюль. Врач их ласково называет «капсулками», хотя с виду небольшие таблетки на самом деле гиганты. В них полный курс микробиоты здорового донора – 22 миллиарда полезных бактерий. Их предлагают проглотить или, как здесь говорят, пересадить тем, кому, к примеру, при лейкозе, не помогла химиотерапия и трансплантация костного мозга. А, может, даже наоборот – вызвала тяжелые последствия. В коридоре института мы встречаем Юлию – блондинку с ухоженными волосами и ногтями, которой едва дашь больше 40 лет. Сложно представить, что она прошла через 3 пересадки костного мозга и 3 курса химиотерапии. Когда человеку с раком крови или, к примеру, предлейкозным состоянием находят донора – это шанс на спасение. Но надежда на него может умереть с развитием реакции «трансплантат против хозяина».
«Я таяла, как свечка, я похудела молниеносно и очень сильно. При моем росте у меня был вес 36-38 кг максимум», – рассказывает Юлия Корсунская, пациент НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой.
Реакция «трансплантат против хозяина» или РТПХ – это серьезное, зачастую опасное для жизни осложнение, которое возникает примерно у 20–50% пациентов после трансплантации костного мозга или стволовых клеток. Иммунные клетки донора (трансплантат) воспринимают обычные клетки тела реципиента (хозяина) как инородные и атакуют их. Встречается и обратная реакция – когда организм пациента сам отторгает все чужое. Симптомы такого неприятия обычно включают поражение кожи, желудочно-кишечного тракта и печени. РТПХ с трудом поддается лечению и в тяжелых случаях угрожает жизни пациента. При этом чтобы хоть как-то примирить организм и чужие клетки, его намеренно подавляют специальными препаратами – иммунодепрессантами или иммуносупрессорами. На их фоне у пациента часто развиваются тяжелые сопутствующие заболевания. Подселение микробов из кишечника донора препятствует отторжению трансплантата.
«По сути, 30 минут – 30 капсул. И все! И через 3-4 дня ты здоров и забыл про все таблетки!» – говорит Игорь Бойков пациент НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой.
Загорелый и поджарый бизнесмен средних лет – Игорь только что вернулся из семейного отпуска в Турции, хотя еще недавно не мог даже передвигаться без боли. «От горшка до горшка», – по его собственному выражению. После пересадки собственных стволовых клеток и с десяток химий в его организме развилось тяжелейшее расстройство кишечника – колит. Его симптомы – диарея, лихорадка и острые боли в животе. Болезнь вызывает бактерия, некоторые штаммы которой устойчивы к антибиотикам. Возможны серьезные поражения внутренних органов – от эрозии до глубоких язв с сильным болевым синдромом. Высок риск летального исхода. Пересадка микробиоты буквально вернула Игоря с того света. Мужчина на пятом десятке вновь стал молодым отцом.
Разложить микробиоту на нуклеотиды
О пользе от трансплантации фекальной микробиоты было известно еще примерно 1700 лет назад, когда китайские врачи пытались таким методом лечить диарею у пациентов. В середине прошлого века – в 1958-м про микробы вспомнили благодаря публикации американского хирурга Эйземана. И снова забыли. В 2000-е эта тема вновь стала актуальной, когда ученые научились «читать» ДНК – с помощью молекулярных методов деления ее на маленькие фрагменты и последовательности. Благодаря этому появилась возможность определить весь спектр бактерий, входящих в микробиоту. По совокупности идентифицированных небольших фрагментов ДНК ученые определяют весь видовой спектр микробов (прим. – микробиом), которые живут в толстом кишечнике.
СПРАВКА: Микробиом человека – это совокупность всех бактерий организма. Количество микробов, населяющих человека, в несколько раз больше количества его клеток. Основные участки их расселения – кожа, молочные железы, половые органы, легкие, слизистые оболочки, биологические жидкости, желчевыводящие пути и желудочно-кишечный тракт. Кишечник, как говорят врачи, – отвечает практически за половину иммунитета человека.
Долго и дорого
Процесс этот из-за высокоточной техники, дорогих ферментов и реактивов, мягко говоря, не быстрый и не дешевый.
«Исследование проводится в несколько этапов. Сперва нам нужно выделить ДНК. Это специальный лабораторный этап. ДНК готовится, ее мы загружаем в прибор, который называется секвенатор – он прочитывает молекулы ДНК. А дальше работают био-информатики, которые анализируют все эти фрагменты и выводят, собственно, весь состав микробиоты, который характерен для того или иного человека. Весь этап от выделения ДНК до получения финальных результатов может занять 3-4 дня. Этот метод открытый и имеет разную разрешающую способность – мы можем идентифицировать микроорганизмы до семейств, до родов, а можем до видов – до простейших вирусов и бактерий в зависимости от поставленной задачи. Соответственно, чем выше разрешение, тем больше стоимость этого исследования. Это как оптика у фототехники – чем выше точность, тем лучше и соответственно дороже должна быть оптика – стекло фотоаппарата. В зависимости от того, какое разрешение мы используем для секвенирования, от сложности работы с биоматериалом это могут быть десятки-сотни тысяч рублей на один образец», – объясняет тарший научный сотрудник отдела медицинской микробиологии и молекулярной эпидемиологии Детского научно-клинического центра инфекционных болезней федерального медико-биологического агентства Владимир Гостев.
В лаборатории при Первом Медицинском университете за разными пробирками, микроскопами и другим неведомым простому обывателю оборудованием трудятся десятки ученых. Из самого понятного – приборы для ПЦР-диагностики. С помощью них ученые, грубо говоря, экономят время и деньги (того и другого врачам и их тяжелобольным пациентам всегда не хватает). Тестирование удешевляет и ускоряет процесс контроля за приживлением микробиоты.
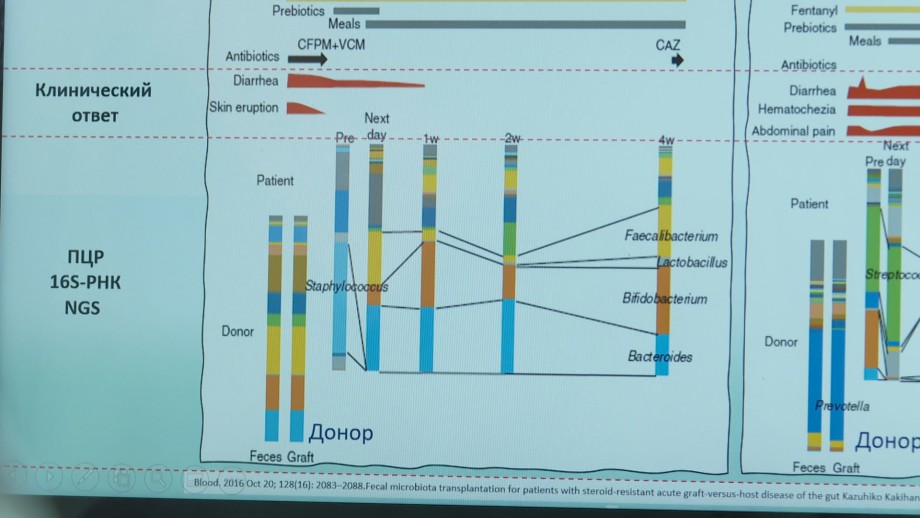
Как это выглядит, Олег Валерьевич показывает нам на экране ноутбука. Если у здорового донора столбик, обозначающий микробиом, окрашен в разные цвета радуги, то у больного – он блеклый и почти двухцветный. Задача врачей, если совсем просто, в кратчайшие сроки «раскрасить внутренний мир пациента» – сделать его таким же разнообразным, то есть более здоровым, как у донора.
«И вот в итоге мы получаем вот точно такой же столбик, как и у донора, – вот это как раз результат 16с-секвенирования, и соответственно, уменьшается диарея, уменьшается болевой синдром, значительно снижается уровень иммуносупресии, отменяются антибиотики – конечно, это здорово!» – говорит Олег Голощапов.
Найти рядового донора
СПРАВКА: По статистике ВОЗ, ежегодно в мире проводится более 50 тысяч трансплантаций костного мозга. Однако 70% пациентов ее не дожидаются и умирают. Донора костного мозга подбирают с учетом совместимости особых белков-меток, которые позволяют иммунной системе организма отличать свои ткани от чужих, – это называется гистосовместимостью. И чем она выше, тем больше вероятность выздоровления. В случае с родственниками ее минимальный показатель 50%, не родные люди должны подходить более чем на 90%. Но проблема в том, что белки-метки индивидуальны, примерно как внешность или отпечатки пальцев человека. Поэтому найти донора костного мозга сложно даже среди родителей, братьев или сестер.
Примерно то же самое и с донорами микробов. Найти подходящего – как отобрать космонавта для полета на Марс. Большинство отсеивается еще на первом этапе отбора.
«Без сомнения, микробиота у нас у всех очень разная, но опять же, возвращаемся к внешним факторам, которые действуют на человека. Ну, условно говоря, медицинские работники могут быть донорами? Вроде бы, почему нет?! Есть и реципиент рядом и доноры рядом – так удобненько! Но на самом деле нет не колонизированных условно патогенной флорой медицинских работников. То есть люди, которые находятся в медицинских стационарах, ухаживающие, родственники – они вообще не рассматриваются в качестве донора. Или, например, вегетарианцы. В принципе, наверное, могут быть донорами... Вегетарианцы – с виду здоровые такие! И мы тоже так думали, более того, мы даже гонялись за какими-то вегетарианцами, чтобы исследовать их, и что в итоге? У них самое маленькое микробное число. Конечно же, мясных продуктов в рационе нет. Зачем там лишние микробы в рационе. Я имею в виду самое маленькое количество активно метаболизирующих бактерий, то есть, по большому счету, здоровый вегетарианец тоже не подходит. Ведь разнообразное питание, без сомнения, должно быть у доноров – есть такое понятие как европейская диета – рыба, мясо, овощи – это идеальный вариант», – говорит Голощапов.
Универсальная пилюля, или Ключ к бессмертию
Для того чтобы микробиота прижилась, она должна быть разнообразной. Этого достигают путем смешивания материалов от разных доноров – от 3 до 5. Тогда эффективность трансплантации, по всем литературным источникам, как утверждает Олег Голощапов, значительно возрастает. Чем больше разнообразия, например, у пациента перед трансплантацией костного мозга, тем меньше сепсиса, меньше антибиотиков и больше выживаемость. Ученые уже доказали существование оси «мозг – кишечник». Микробы влияют на все, даже на наше серое вещество. Пересадка микробиоты на полном серьезе рассматривается и изучается по всему миру в качестве лекарства от рассеянного склероза, аутизма и болезни Паркинсона.
«Существуют отдельные виды бактерий, которые действительно находят гораздо чаще в кишечнике у долгожителей, и это, наверное, очень перспективно, но, скорее, может, на первых этапах для фармакологических компаний. Представляете, какая находка – вот мы нашли бактерию, которая продлит вашу жизнь! Но не все так просто, конечно же! Универсальный метод – это, конечно, проведение трансплантации микробиоты, но каждое направление медицины – условно, неврология, нефрология изучает своих пациентов после трансплантации микробиоты. И у всех разные клинические проявления, разные маркеры ухудшения или улучшения состояния. Ни в коем случае нельзя рассматривать этот метод как универсальную пилюлю. Пока он просто нуждается в дополнительных исследованиях и, скорее всего, имеет очень значительные перспективы», – отмечает врач.
За 7 лет экспериментальной практики группа врачей под руководством петербургского «Доктора Стрэнджа» Олега Голощапова провела более 60 трансплантаций донорской микробиоты. Согласно результатам клинических исследований, 80 процентов из них дали положительный результат. Цель реальных супергероев – довести эту цифру до 100!
Читайте также:
Подробнее в сюжете: Мировой сюжет